近日,我院和瑞典卡罗林斯卡医学院研究团队在 Nature子刊Nature Communications (IF=17.694)上发表研究论文Pancreatic tumor eradication via selective Pin1 inhibition in cancer-associated fibroblasts and T lymphocytes engagement。该研究开发了一个基于CAFs靶向性抗体和DNA条形码束胶系统的脯氨酰异构酶PIN1抑制剂递送系统,该系统借助CD8+T细胞特异性核酸适配体将CD8+T细胞引入肿瘤内部,在小鼠胰腺癌原位模型中实现了胰腺肿瘤清除,通过重塑肿瘤微环境实现小鼠胰腺癌的治疗。
我院为论文作者第一单位,我院甲状腺外科/疾病相关分子网络前沿科学中心/呼吸健康研究所助理研究员刘嘉烨,肝脏外科硕士研究生牟春阳,瑞典卡罗林斯卡医学院博士研究生王蛘为论文第一作者,甲状腺外科李志辉教授、肝脏外科文天夫教授、糖尿病与代谢研究中心郑晓峰研究员、胃肠外科刘勇副教授为论文共同通讯作者。
CAFs是肿瘤微环境中主要的间质细胞成分,可通过多种机制维持免疫抑制肿瘤微环境、限制免疫细胞的浸润,从而促进肿瘤的生长。越来越多的证据表明,脯氨酰异构酶PIN1在多种肿瘤的癌细胞和CAFs细胞中过表达,可调节其底物的生物活性、蛋白质降解或细胞核-细胞质分布,激活多种促癌信号通路,对肿瘤的发生和进展产生关键影响。因此,抑制脯氨酰异构酶Pin1的活性被认为是潜在的抗癌策略,然而现有的脯氨酰异构酶Pin1抑制剂均无法有效进入实体瘤内部。
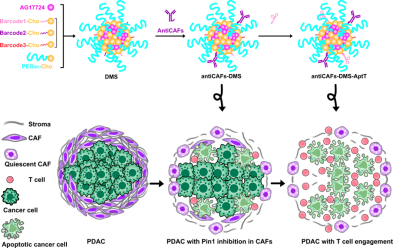
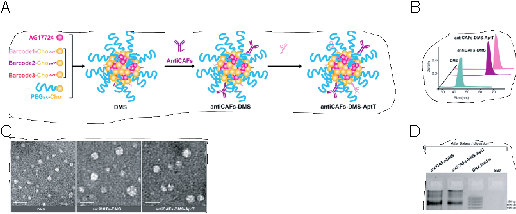
本研究通过自组装的方式,使用PEG5K-胆固醇、DNA条形码胆固醇和脯氨酰异构酶PIN1抑制剂AG17724先后合成了DNA条形码微细胞系统(DMS)、抗成纤维细胞-DNA条形码微细胞系统(antiCAFs-DMS)和抗成纤维细胞-DNA条形码微细胞系统-结合T细胞的DNA适配体(antiCAFs-DMS-AptT),并对其结构及稳定性进行了表征。
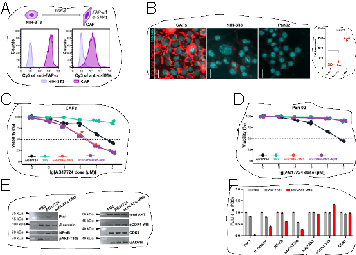
然后,通过体外实验证实了antiCAFs-DMS和antiCAFs-DMS-AptT能够将脯氨酰异构酶Pin1抑制剂AG17724选择性递送至CAFs实现对CAFs的抑制,而对肿瘤细胞无明显影响。同时,antiCAFs-DMS和antiCAFs-DMS-AptT能够明显降低CAFs中脯氨酰异构酶Pin1下游信号分子的表达程度。
接着,将孵育后的antiCAFs-DMS-AptT与CD8+T细胞引入到CAFs-肿瘤细胞共培养体系中,并通过免疫荧光证实了antiCAFs-DMS-AptT能够促进CD8+T细胞进入胰腺肿瘤内部。

最后,在小鼠胰腺癌原位肿瘤模型中证实了antiCAFs-DMS-AptT能够通过清除肿瘤微环境中的CAFs并增加CD8+T细胞的浸润来清除胰腺肿瘤。
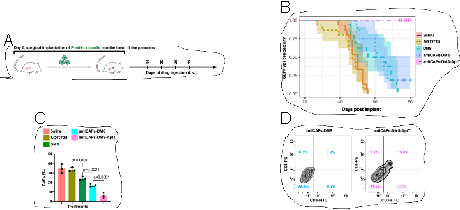
综上所述,本研究开发了一个基于CAFs靶向性抗体和DNA条形码束胶系统的脯氨酰异构酶PIN1抑制剂递送系统。该系统在借助CD8+T细胞特异性核酸适配体的基础上,能够增加肿瘤微环境中CD8+T细胞的浸润,通过重塑肿瘤微环境实现小鼠胰腺癌的治疗。
原文链接:https://doi.org/10.1038/s41467-022-31928-7